Nekada smo sapune vezivali isključivo za održavanje higijene: najjednostavniji bijeli sapuni u kupatilu koje mama kupi u ogromnim zalihama kako bi potrajali čitav mjesec. Danas su oni, čini se, pravo „in“. Ono što je meni najinteresantnije je cijena tih simpatično upakovanih, a jednostavnih proizvoda za čišćenje. Prirodni „home-made“ sapuni, kako vidim, dobivaju poene upravo na nepravilan i hrapav izgled, na ne toliko intenzivne boje, prisustva nekih drugačijih (a možda i ne) sastojaka jer... pa prirodni su! Ja bih poene dala na kreativnost: naime, oni što izgledaju kao kolači su zaista simpatičan poklončić; zatim na trud i ulaganje vlastitih sredstava u sastojke potrebne za izradu i to je otprilike to. Ipak, prije nego u svemu vidite dobar način zarade i počnete googlati kojekakve tutorijale o pravljenju sapuna, morate znati da se u tom procesu koriste neke jake (i ne baš tako jeftine) hemikalije. U principu, u nekom idealnom svijetu, nastavnik bi prilikom obrade lekcije iz organske hemije koja nosi naziv "Sapuni i saponifikacija" mogao izdvojiti školski čas ili dva da nas nauči samom nastanku sapuna. Možda nekim eksperimentom? (Kao da već niste pretpostavili.)
I počnimo...
Osnova kod ovih eksperimenata će nam biti ricinusovo ulje. Ono, osim što je dobar laksans, dosta se koristi u kozmetici i u reakciji sa toplim koncentrovanim bazama gradi spaune. Osim toga, ovo biljno ulje sadrži spojeve sa hidroksilnim grupama (-OH) koje reaguju sa koncentrovanom sumpornom kiselinom i stvaraju dugolančanu molekulu koja na jednom kraju ima jonizovanu sulfonatnu grupu. Takve molekule se ponašaju kao deterdženti.
Iako su nam za eksperiment potrebne samo male količine reagenasa, treba uzeti u obzir da koristimo koncentrovane rastvore sa kojima definitivno treba rukovati s oprezom. Zbog toga eksperimente trebaju izvoditi pouzdani učenici uz nastavnički nadzor ili, ako nastavnik nije sasvim siguran u svoje učenike, on sam može izvesti eksperimente pred razredom tokom dva školska časa (jedan eksperiment traje oko 45 minuta).
Šta nam sve treba?
- Ricinusovo ulje (oko 5 mL)
- Etanol (5 mL)
- 5M Natrijev hidroksid (10 mL)
- Natrijev hlorid (10 g)
- Koncentrovana sulfatna kiselina (2 mL)
- Destilovana voda
- Četiri epruvete
- Tri veće epruvete
- Stalak za epruvete
- Čep za epruvetu
- Dvije menzure od 10 mL
- Dvije laboratorijske čaše od 100 mL
- Jedna čaša od 250 mL
- Stakleni štapić
- Špatula
- Plamenik
- Tronožac
- Podmetač otporan na toplotu
- Vrela voda zagrijana na električnom rešou
- Ledena (poželjno) ili veoma hladna vodena kupka
- Guč-boca
- Mali Bihnerov ili Hiršov lijevak
- Vodeni aspirator
- Filter papir izrezan na potrebnu veličinu
- Rola kuhinjskog ili sličnog papira
- Kapaljka
Postupak pravljenja sapuna
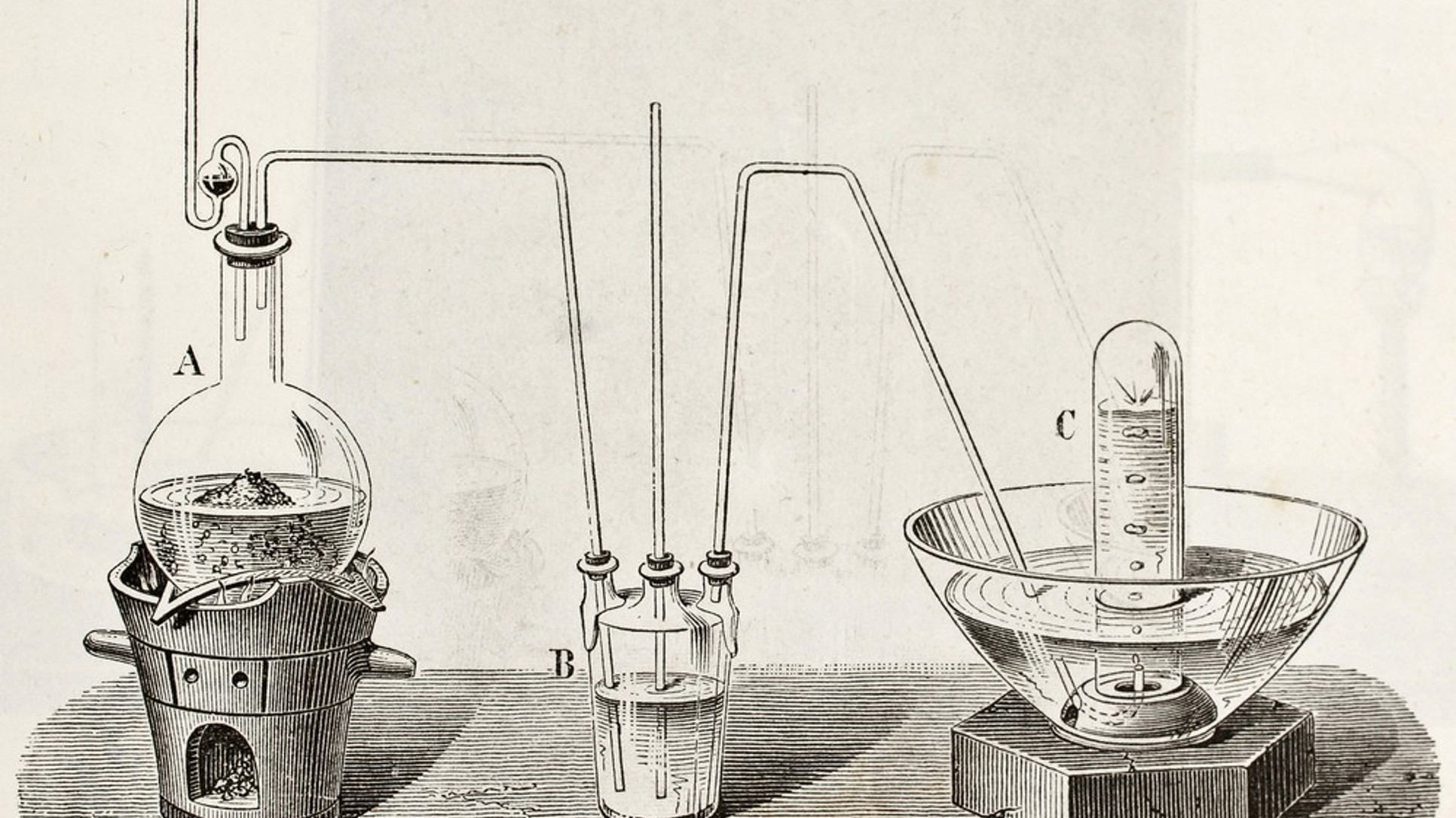
Oko 2 mL ricinusovog ulja uz pomoć kapaljke prenesemo u čašu (100mL) i dodamo mu 5 mL etanola. Sve to dobro promiješamo staklenim štapićem, a zatim dodamo 10 mL 5M rastvora natrijevog hidroksida. U međuvremenu, učenici mogu pripremiti vodeno kupatilo. Vrela vodena kupka se može pripremiti i u velikoj čaši (250 mL) u blizini električnog rešoa, od malo vode, kako bi u nju mogli uroniti malu čašu bez prosipanja. Nakon što smo malu čašu uronili u vrelu vodu, sadržaj ćemo kontinuirano miješati štapićem pet minuta. (Ako nam se voda previše rashladi, dosipamo novu vrelu vodu sa električnog rešoa.) Nakon toga ćemo dodati prethodno pripremljen zasićeni rastvor natrijevog hlorida i promiješati. Rastvor može pripremiti druga grupa učenika u velikoj epruveti, tako što će natrijevom hloridu dodati 10 mL vode i mućkati dok se on sasvim ne rastvori.
Smjesu ćemo ohladiti u hladnoj ili ledenoj kupki i posmatrati kako se u smjesi postepeno stvara meko, bijelo grumenje sapuna. Sve ćemo ostaviti da tako odstoji nekoliko minuta kako bi prinos bio što veći. Nakon nekog vremena sapun može izroniti i tokom hlađenja na površini formirati meku koricu. Aspiratorom ćemo isfiltrirati sapun. Po potrebi možemo izlomiti formiranu koricu staklenim štapićem.
Sapun ćemo zatim staviti na paprini ručnik da se ocijedi, ali ne dodirivati prstima jer može još uvijek da sadrži određenu količinu natrijevog hidroksida. Uz pomoć špatule prenesemo nešto sapuna u epruvetu i dodamo nekoliko mililitara destilovane vode, dobro promiješamo i... Imamo sapun!
A može i deterdžent...
U veću epruvetu treba dodati 4 mL koncentrovane sumporne kiseline. Obzirom da se ovdje radi o koncentrovanoj jakoj kiselini, poželjno je da ovaj korak učini nastavnik. Uz pomoć kapaljke ćemo tome s velikim oprezom dodati 2 mL ricinusovog ulja. Šta se događa? Primijetit ćemo da je epruveta postala vruća. U drugu epruvetu ćemo dodati oko 10 mL hladne vode (u visini od 3-4 cm), a zatim u nju presuti sadržaj iz prve epruvete. Obzirom da je smjesa jako viskozna, ona će sporo oticati te ne treba žuriti, osim toga sadrži koncentrovanu sumpornu kiselinu i oprez je svakako neophodan.
Dobro ćemo promiješati štapićem da bi se uklonio višak kiseline, a na dnu epruvete će se formirati sivoružičasti talog. Dekantiranjem ćemo ga odvojiti od vode (vodu odspemo u slivnik). Još dva puta ćemo dobiveni proizvod na isti način saprati vodom. Špatulom ćemo malu količinu taloga prenijeti u čistu manju epruvetu i dodati mu nekoliko mililitara vode, dobro promiješati i... To je to! Napravili smo deterdžent.
Ko s kime (reaguje)?
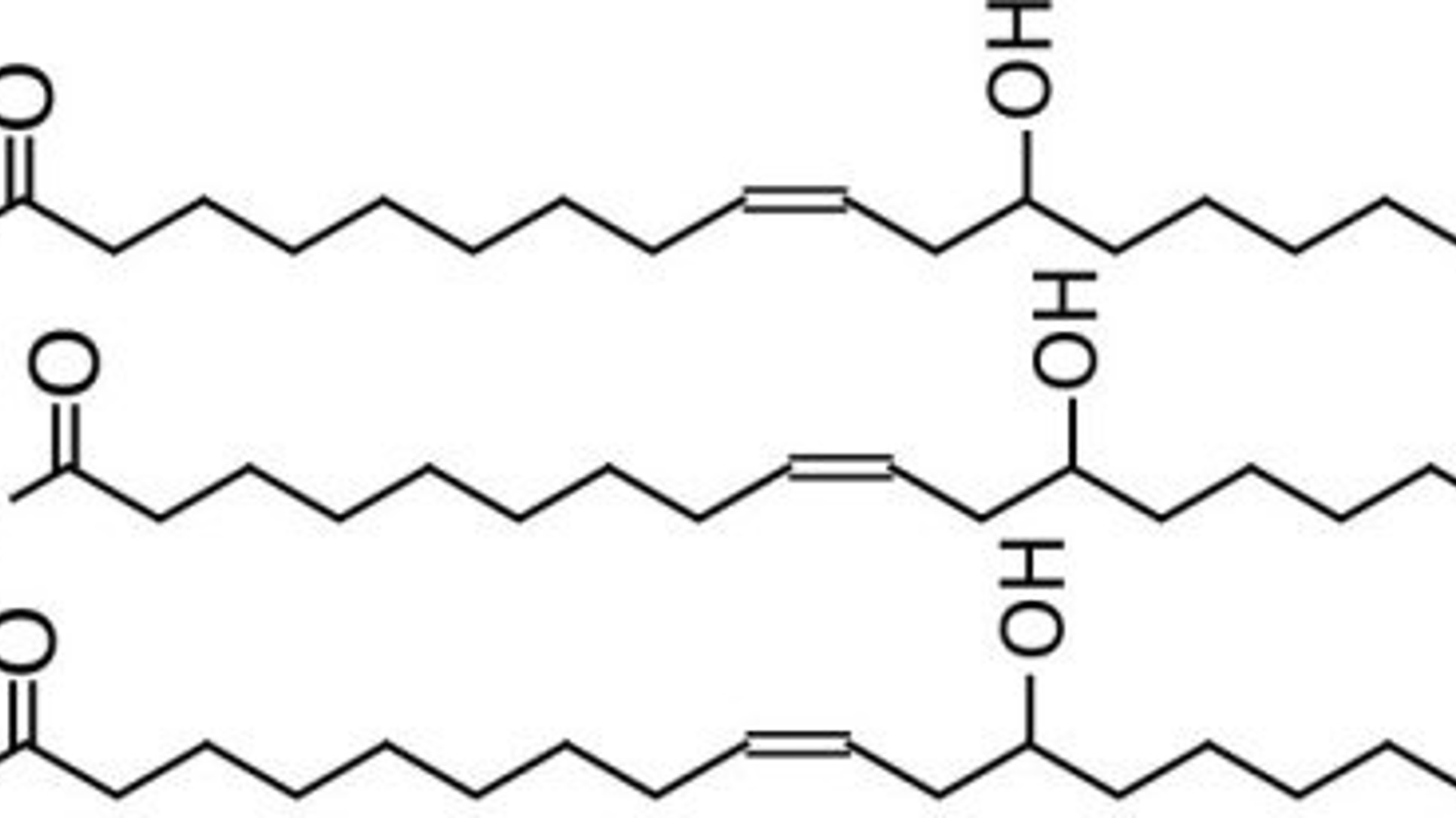
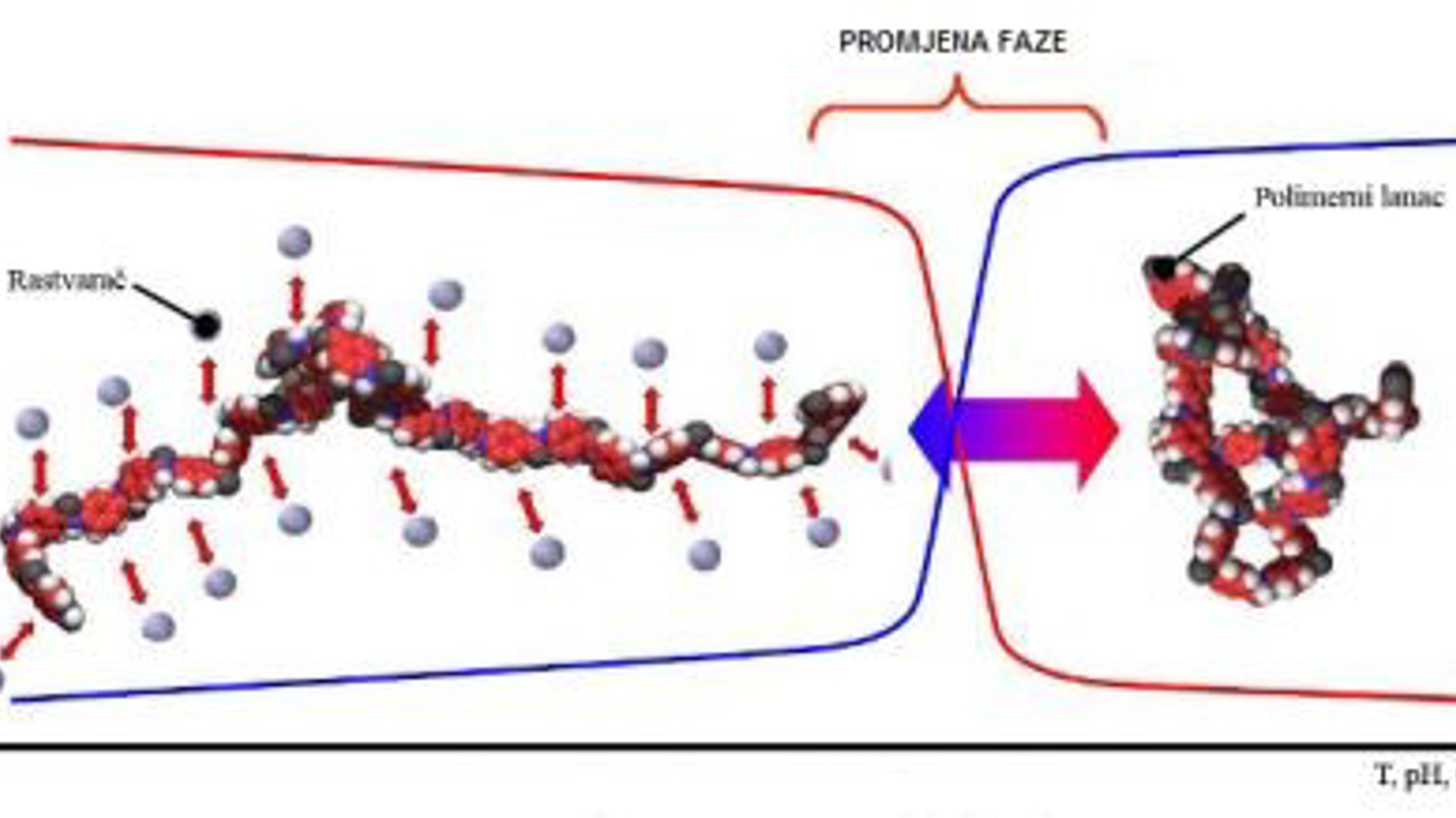
Ulja su primjer triglicerida, koji su esteri alkohola glicerola (glicerina) i masnih kiselina (obično od 16 atoma ugljika). Tri masne kiseline se preko svojih karboksilnih grupa vežu za tri hidroksilne grupe glicerola. Primjer jednostavne strukture triglicerida:
Kod ricinusovog ulja masne kiseline u svojim lancima imaju 18 atoma ugljika, jednu hidroksilnu grupu i dvostruku vezu (spadaju u nezasićene) koja je odgovorna za tečnu konzistenciju ulja – zasićene masne kiseline grade čvrste masti. Uz dodatak natrijevog hidroksida i zagrijavanje, glicerol se odvoji, a umjesto njega se natrijev jon veže za karboksilnu grupu masne kiseline i tako nastaje natrijev ricinoleat, koji predstavlja sapun. Dakle, sapuni su soli viših masnih kiselina.
Natrijev ricinoleat ima antibakterijsko, ali i iritirajuće dejstvo na osjetljivu kožu i sluznice pa može izazvati alergijske i druge reakcije preosjetljivosti. Ovo je zbog konstituenasa vrlo otrovnog sjemena ricinusa, koji se prilikom prozvodnje mogu odstraniti.
Kod drugog eksperimenta tri masne kiseline preko hidroksilne grupe na svom lancu reaguju sa koncentrovanom sulfatnom i nastaju sulfonske kiseline, opšte formule: RS(=O)2-OH. R predstavlja organsku alkil ili aril grupu i ona nije topiva u vodi, a S(=O)2-OH je sulfonatna grupa koja je topiva u vodi. Ove osobine ovakve molekule čine dobrim deterdžentima jer se R veže za masne mrlje, a sulfonil hidroksid se otapa u vodi. Ovaj deterdžent od ricinusovog ulja je inače prvi sintetski deterdžent ikad napravljen, a još uvijek se koristi u nekim uljima za kupanje.
Ricinusovo ulje je najbolje za pravljenje sapuna u školskom laboratoriju, ali zadovoljavajući rezultati se mogu postići i sa maslinovim. Ipak, kod pravljenja deterdženta procesom sulfonacije moramo koristiti ricinusovo ulje jer njegove masne molekule na karbonskom lancu imaju hidroksilnu grupu koja je esenencijalna za odvijanje ovog procesa.
Nadam se da je nakon ove lekcije barem malo lakše razlučiti šta je „prava stvar“, a šta nam prodaju pod (bijele) bubrege.
Još eksperimentalne nastave? Čitajte i druge tekstove:
... i mnoge druge.
Ko čita, ne skita!